細胞凋亡療法的“關鍵一躍”
2024-11-23 01:37:56 1
本文系基於公開資料撰寫,僅作為資訊交流之用,不構成任何投資建議。
凡人皆有一死,細胞亦是如此。
作為生物體最基本的構成單位,每一秒都有無數細胞“死亡”,導致這些細胞死亡的最主要原因,即是細胞凋亡。所謂細胞凋亡,不同於被動發生的細胞壞死,而是由特定基因驅動的主動過程,可以看作是細胞的壽終正寢。
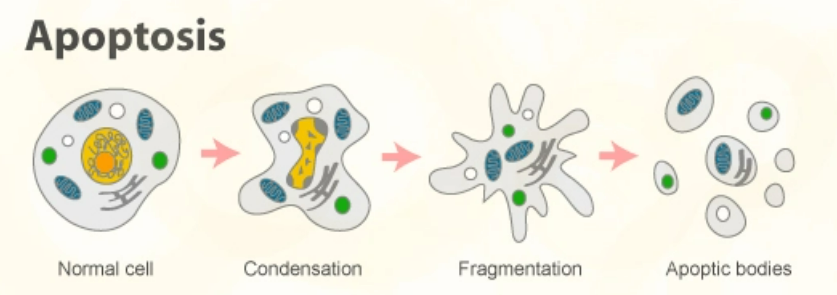
然而,當細胞發生基因突變而產生癌變時,就會異常地加速繁殖,而且也不會像正常細胞一樣觸發細胞凋亡。現存的大多數癌症靶向療法,主要透過啟用免疫系統的方式來殺死癌細胞,可其實如果能夠誘導癌細胞重啟凋亡,那麼也有望高效地殺死癌細胞。
細胞凋亡這一概念,最早由Kerr等三位科學家在1972年首次提出,但直到1985年細胞凋亡途徑中的重要蛋白Bcl-2蛋白家族被發現,這一研發思路才真正開始在產業中得到落地。
透過抑制關鍵蛋白,而重啟癌細胞的主動凋亡,這一原理看似並不複雜,但卻在產業落地過程中遭遇巨大的困難。如今四十年的時間過去了,無數藥企入局研發,可除了艾伯維的維奈克拉(Venclexta),再無第二款細胞凋亡療法獲批。儘管維奈克拉在商業化方面大放異彩,但依然存在一定的安全性問題。
巨大的臨床未滿足需求下,亞盛醫藥的1類新藥力勝克拉片(lisaftoclax,APG-2575片)上市申請於11月16日獲得CDE受理,並被CDE納入優先審評。極有可能成為中國首款,全球第二款細胞凋亡療法。
細胞凋亡療法即將迎來“關鍵一躍”,一個嶄新的時代或許就要開啟。
01
Bcl-2成藥的三座大山
細胞凋亡是一種全新的解題思路,因此並沒有任何的研發經驗可以借鑑,藥企只能摸著石頭過河。既然是摸著石頭過河,其中就必然伴隨著失敗,Bcl-2的研發之路,堪稱一部藥企失敗血淚史。
Bcl-2的成藥難點主要有三個:成藥性與分子活性的兼顧、水溶性問題、靶點問題。這每一個問題背後,都花費了業界十年的時間去尋找答案。
首先,Bcl-2家族是透過形成二聚體的方式來實現功能,隸屬於PPI結合(蛋白-蛋白結合),結合介面很大,透過20個氨基酸形成一個複雜的相互作用區域。如果想要透過小分子藥物去阻斷PPI結合,做出來的分子量肯定非常大,成藥性很差,是很難落地藥物臨床研發的。
但如果分子量過小了,又極有可能遇到分子活性不夠高的問題,進而造成細胞水平的脫靶問題。因此為了兼顧成藥性與分子活性,藥企只得一次又一次地進行嘗試,在兩者之間尋求平衡。
可這僅是困難的開始。當藥企找到了合適的分子後,又會遇到水溶性問題的新問題。Bcl-2最好是每天給藥,這就意味著分子必須具備很好的水溶性,才有做成口服的可能。在無數分子中篩選出水溶性好的分子,這就成為擋在Bcl-2靶點前面的第二座大山。
最後則是靶點問題。Bcl-2家族有Bcl-2、Bcl-xL、Bcl-w等多個靶點,到底應該靶向哪個靶點呢?最開始的時候,業界也曾嘗試使用多靶點的分子,但經過不懈的努力證實,Bcl-xL,Bcl-w靶向劑會殺死成熟的血小板,因此只有靶向Bcl-2單個靶點的分子才是最合適血液瘤的。
一個又一個的困難,使得Bcl-2成藥之路頗為坎坷。從最早的生物化學,到後來的結構生物學,藥企經歷了無數迭代,才最終篩選出兼顧成藥性與分子活性、水溶性又好,又不會脫靶的有效分子。
亞盛醫藥的創始團隊是最早一批關注Bcl-2靶點的科學團隊,兩位創始人王少萌、楊大俊早在20世紀90年代中期,就在喬治城大學Lombardi 癌症中心開始研究Bcl-2靶點。
2003年的時候,他們在美國成立了Ascenta Therapeutics 公司,正式著手進行Bcl-2靶點的產業落地。一年之後開始推進當時最有效的,也同時抑制三個Bcl-2家族蛋白(Bcl-2,Bcl-xL andcl-1)的口服小分子抑制劑AT-101進入美國臨床試驗。不過,受限於當時的技術,AT-101的後續研發還是走了許多彎路。
經歷了AT-101試錯以及長達二十年的沉澱,亞盛團隊擁有了極強的研發競爭力,僅實驗室的先導化合物和各種最佳化的小分子化合物就做了成千上萬,關於Bcl-2的專利和文章更是絕對全球領先。在經過數千分子篩選後,亞盛醫藥最終在2013年選出了合適的新分子APG-2575,並在2018年將其推進至臨床。另一方面,同樣經歷了兩次失敗的艾伯維,也在2016年成功孵化了維奈克拉。
無論是已經成藥的艾伯維,還是已遞交新藥上市申請的亞盛醫藥,它們都是經歷了一次又一次失敗才摸到了勝利之門。
02
不完美的突破
作為一種全新的抗癌思路,細胞凋亡療法可謂意義重大,它可以解決傳統小分子藥物的耐藥性,有望成為BTK抑制劑後的重磅藥物。
一項真實世界研究表明,伊布替尼治療失敗後,換用免疫化療的客觀緩解率(ORR)為25%,換用CD20單藥的ORR為36%,換用Bcl-2抑制劑的ORR可高達76%。美國國家綜合癌症網路(NCCN)指南已將Bcl-2抑制劑推薦為BTK治療失敗的CLL/SLL患者的治療首選。
維奈克拉是目前唯一一款上市的細胞凋亡療法藥物,一經上市即獲得了投資者的熱切關注,並且不負眾望的成為營收超20億美元的重磅藥物。艾伯維2023年報顯示,維奈克拉營收達22.88億元,同比增長13.9%。
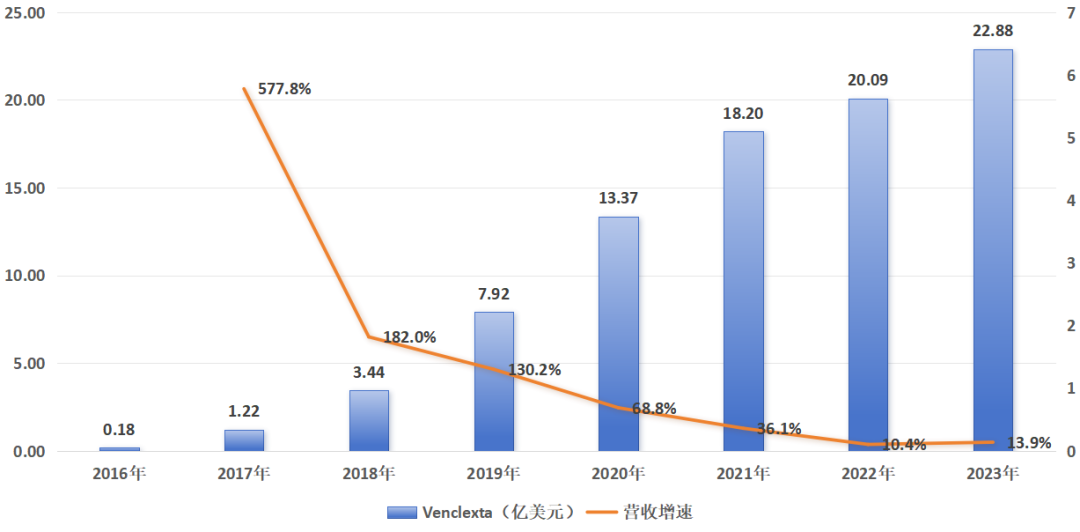
圖:維奈克拉營收趨勢一覽,來源:錦緞研究院
然而,維奈克拉不俗的商業化表現背後,卻是不可忽視的臨床風險。儘管維奈克拉在臨床設計時,已經選擇保守的劑量遞增方案進行給藥:從低劑量逐步增加,第一週至第五週逐漸進行劑量爬坡,到達第五週後才能開始維持最大劑量。
但即使如此卻依然會出現嚴重的腫瘤溶解綜合徵(TLS)。2022年的時候,英國藥品和健康產品管理局(MHRA)釋出了關於維奈克拉會出現腫瘤溶解綜合徵(TLS)的風險警示:部分患者在使用最小劑量的滴定方案時,依然出現了TLS導致的死亡報告。
自2016年4月獲批,至2021年10月,英國不良事件報告系統(黃卡系統)共收到28份與維奈克拉使用有關的TLS疑似藥品不良反應報告,其中有7份為死亡報告。
無可否認,維奈克拉是一款成功的藥物,它成功開啟了細胞凋零療法的大門,並且已經取得了商業化的成功。可受限於安全性問題,導致其註定不會成為一款完美的藥物。
03
厚積薄發的“飛躍”
維奈克拉證明了細胞凋亡機制是成功,但同時安全性問題也不容忽視。Bcl-2抑制劑臨床上的最大痛點,不在於療效的提升,而在於安全性風險的降低。
亞盛已遞交新藥上市申請上市的APG-2575,正是一款安全性顯著提升的Best in class產品。基於藥代動力學方面半衰期較短的獨特性,APG-2575能夠更加快速的進行給藥。在臨床設計中,APG-2575沒有選擇維奈克拉的每週劑量遞增方案,而是採取每日劑量梯度遞增給藥,4-6日達到目標劑量,用藥方案更加靈活,患者應答速度也更快。
經過了1000多位病人的臨床驗證後,APG-2575相對看似更激進的劑量遞增方案並沒有發生嚴重的TLS反應,恰恰相反APG-2575出現TLS的機率非常低。在療效與維奈克拉旗鼓相當的情況下,APG-2575在安全性方面有了極大的提升,有望滲透到更廣泛的患者群體中,填補維奈克拉所不能滿足的臨床空白。
此外,APG-2575的價值並不僅僅在於對維奈克拉的單藥替代,更為重要的是它在與其他藥物聯用時,展現出成為血液瘤基石藥物的潛質,有望聯用BTK抑制劑、利妥昔單抗、耐立克等明星藥物,從而搶得更大的血液瘤市場。
APG-2575的多項臨床進展入選即將於今年12月正式召開的2024美國血液學會(ASH)年會,其中包括 APG-2575單藥或聯合阿可替尼或利妥昔單抗治療初治、復發/難治性或既往接受過維奈克拉(ven-treated)治療的CLL/SLL的最新臨床資料。
療效資料顯示,在87例接受APG-2575聯合阿可替尼治療的患者中,客觀緩解率(ORR)為96.6%,12個月和18個月的PFS率分別為89%和86%。
其中,有14例曾接受過維奈克拉治療:其中9例在既往維奈克拉治療中進展,3例在完成維奈克拉治療後復發,2例因維奈克拉不耐受而停藥,ORR為85.7%(12/14)。在既往接受過維奈克拉但未接受過BTK抑制劑治療的患者中,ORR為100%(8/8);在既往接受過維奈克拉和BTK抑制劑治療的患者中,ORR為66.7%(4/6);
此次研究資料表明,APG-2575聯合阿可替尼對既往接受過維奈克拉治療的患者有效,包括在維奈克拉治療中進展的患者。這項隨訪時間較長的更新分析顯示,在接受APG-2575單藥治療/聯合治療的初治或R/R CLL/SLL患者中未觀察到藥物相互作用或新的安全性問題。
APG-2575成為首個上市的國產BCL-2抑制劑,這將僅是亞盛醫藥邁出的一小步。隨著與BTK聯用效果的不斷驗證,其必然會逐漸提升至一線療法,甚至拓展至AML,MDS、MM等更多適應症。伴隨4項全球註冊III期臨床試驗快速推進,APG-2575的價值將不僅限於國內,優秀的臨床資料使其具備了角逐全球市場的競爭力。
一直以來,投資者都在探討到底什麼才算是真創新,其實這本就是一個“偽命題”。確實,從技術角度看,新靶點、新技術、新分子都算作創新,但這些只是創新的表象,成功是需要長時間積累與迭代的。
例如亞盛醫藥APG-2575的突破,正是三十年磨一劍的成果。
在最開始的研發中,亞盛醫藥並不知道Bcl-2靶點是能夠成藥的,而是經歷了一系列的篩選與研究,幾乎將Bcl-2家族的所有靶點都做了個遍,才最終確定了Bcl-2靶點的大方向。一開始做出來分子活性不好,選擇性不好,口服利用率不好,這些都是家常便飯,每一次嘗試都需要耗費大量的時間,進入臨床研究之前亞盛就進行了整整十年的基礎研究。
沒有這長達十年的基礎研究,也就不會有亞盛如今的碩果。APG-2575正是亞盛研發積累的集大成者,雖然其僅是2018年進入臨床的新分子,但很快獲得了快速的發展,並一路收穫瞭如今的成績。如果沒有之前二十多年的積累,沒有亞盛一直以來的堅持,APG-2575也是不可能成功的。
真正的創新不應脫離實際,而應該從臨床出發。對於現階段的中國創新藥而言,直接去搞全新的靶點、全新的技術平臺,都是難以最終落地的。真正的創新就是能夠填補臨床未滿足需求的空白,這背後可能需要長達數十年的堅持。
很多時候,臨床未滿足需求並不僅是療效方面,還可能是依從性,亦或是安全性。以Bcl-2靶點為例,最核心的臨床未滿足需求就在於維奈克拉可怖的副作用,APG-2575完美解決了這個問題,對於Bcl-2靶點和細胞凋亡療法來說,都算是一次厚積薄髮式的“飛躍”。
本站內容由互聯網用戶自發貢獻,該文觀點僅代表作者本人。本站僅提供信息存儲空間服務,不擁有所有權,不承擔相關法律責任。如發現本站有涉嫌抄襲侵權/違法違規的內容,請發送郵件至舉報,壹經查實,本站將立刻刪除。
